유럽 식품안전청(EFSA)과 화학물질청(ECHA)이 ‘글리포세이트’ 재평가를 위한 전례 없는 추가 정보(데이터)와 의견 수렴에 나섰다. 아울러 EFSA와 ECHA는 ‘글리포세이트’ 재평가 과정의 나머지 단계에 대한 일정을 수정했다.
AgNews에 따르면 최근 EFSA는 글리포세이트 갱신그룹의 요청에 따라 재평가에 필요하다고 판단되는 많은 양의 과학적 데이터를 추가로 업데이트했다. 이러한 추가 정보는 현재 초기 갱신 평가보고서(dRAR) 초안을 업데이트 중인 EU 4개 회원국(프랑스, 헝가리, 네덜란드, 스웨덴)으로 구성된 ‘글리포세이트 평가그룹(AGG)’에서 철저히 검토할 계획인 것으로 알려졌다.
EFSA와 ECHA는 이러한 배경에서 ‘글리포세이트’ 재평가 과정의 추후 일정을 수정했다.

◇ECHA의 분류=ECHA의 위험평가위원회(RAC)는 이달 30~31일 이틀간의 전체회의에서 글리포세이드의 환경 분류뿐만 아니라 발암성, 유전독성, 생식 및 발달독성 등을 고려한 위험 분류에 대해 논의할 예정이다. RAC의 이러한 의견은 EFSA에 제공되며, 이후 8~10주(2022년 7월 말~8월 중순) 이내에 ECHA 웹사이트에 게시된다. EFSA는 ‘dRAR’의 동료검토(Peer Review, 테스트 이전 작업산출물의 결함을 찾는 활동) 중에 RAC의 의견을 충분히 고려할 방침이다.
◇EFSA의 안전 점검(동료검토)=EFSA는 그동안 공개 상담을 통해 368건의 답변을 받았다. EFSA는 또 회원국 전문가들과 글리포세이트 갱신그룹(GRG)으로부터 약 2400건의 의견을 받았다. 이를 통해 약 3000페이지의 파일이 생성되었으며, GRG와 AGG는 이를 면밀히 검토해야 하며, 업데이트된 dRAR(평가보고서) 준비를 위한 기초로 활용된다.
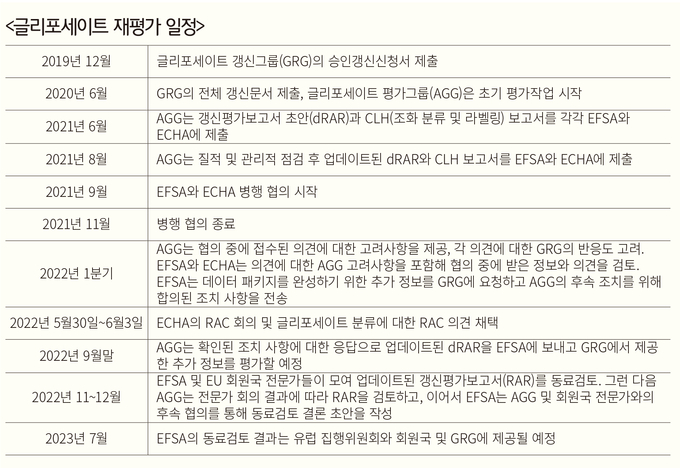
AGG는 2022년 9월 30일까지 업데이트된 dRAR을 제출할 예정이라고 EFSA에 통보했다. 따라서 EFSA는 2022년 11월과 12월에 회원국 전문가들과 농약 동료검토 회의를 열고 2023년 7월에 결론을 내릴 것으로 점쳐지고 있다. 결론적으로 EFSA는 글리포세이트에 노출될 경우 인간과 동물, 환경에 미칠 수 있는 모든 가능한 위험을 평가하게 된다.